Prise en charge à 100 % début 2016
« Je suis favorable à la publication d’une recommandation temporaire d’utilisation du Truvada, un médicament qui doit nous permettre d’avancer significativement dans la lutte contre le VIH », a déclaré la ministre à l’Assemblée, dans le cadre de l’examen du projet de budget de la Sécurité sociale pour 2016.
La ministre a également annoncé que le traitement, dont les effets sont « probants », selon elle, pour réduire les contaminations, serait pris en charge à 100 % « au début de l’année 2016 ».
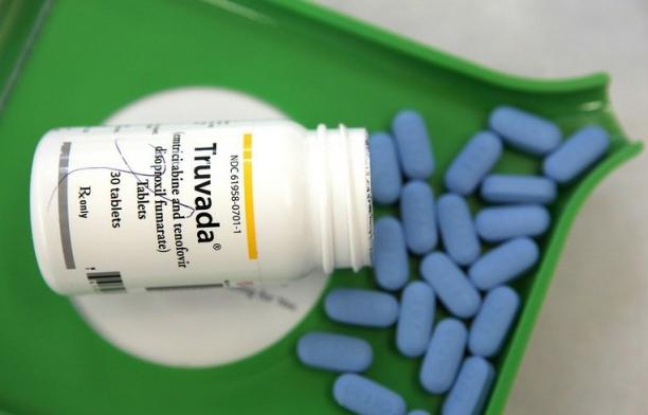
Le Truvada, combinaison d’antirétroviraux du laboratoire américain Gilead, a été mis sur le marché en 2005 en tant que traitement pour les personnes séropositives. Il s’est ensuite avéré que, pris quotidiennement ou même quelques heures avant et après une relation sexuelle, il permettait à des personnes saines de réduire très fortement le risque d’être contaminées par le VIH.
Forte baisse du risque de contamination
Ce traitement relativement onéreux (500 euros la boîte de 30 comprimés) est déjà autorisé aux États-Unis comme traitement préventif.
En France, où selon l’association Aides, chaque mois, plus de 500 personnes découvrent leur séropositivité au VIH, les associations gay et/ou de lutte contre le VIH réclamaient depuis des mois l’autorisation de ce traitement préventif encore appelé « PrEP » pour « prophylaxie pré-exposition ».
Le service des maladies infectieuses et tropicales de l’hôpital Saint-Louis à Paris a déjà commencé au début du mois les premières consultations en France proposant ce traitement préventif, anticipant ainsi un éventuel feu vert des autorités.
Tags:






























-1740075441-1744298713.jpg&h=120&w=187&zc=1&q=70')














